-
草莓状黄铁矿是由相近大小、相似微晶形态的黄铁矿颗粒组成的球形、亚球形聚合体[1],利用特殊的外部形态可与黄铁矿相区分。个体直径一般在数微米至数十微米之间波动,存在于各地质历史时期的沉积岩地层[1-5]、近代海洋和淡水沉积物中[6-7]。关于草莓状黄铁矿最早的研究可追溯到上世纪初,Rust[8]在1935年就对草莓状黄铁矿的结构进行了研究,七十年代后,多个研究团队先后进行了草莓状黄铁矿的形成及来源的研究[9-10]。随着草莓状黄铁矿人工合成实验的开展[6]及对现代黑海的草莓状黄铁矿形成机制及粒径分布规律的研究[1],揭示了草莓状黄铁矿的形成与沉积时古海洋的氧化还原条件密切相关,通过研究沉积岩中草莓状黄铁矿粒径分布特征即可对沉积时的古海洋氧化—还原环境进行恢复[1, 11-14]。这使得草莓状黄铁矿粒径统计和形态分析方法被广泛的应用于各个地质历史时期的古海洋环境研究中[15-28]。
本文在前人研究的基础上,对草莓状黄铁矿的形成机理、恢复氧化还原条件的判别标准和方法以及存在的问题进行论述,旨在通过综合分析草莓状黄铁矿的各项指标,鉴别特殊环境下沉积的草莓状黄铁矿,最终对古海洋氧化还原历程进行更为精确的重建。
-
草莓状黄铁矿的形成机理一直存在争议。早期研究中,由于草莓状黄铁矿的特殊形态其一度被认为是细菌或微生物化石[10, 29-30],虽然这一观点很快被否定,但许多学者仍旧认同草莓状黄铁矿的有机成因。如Berner[31-32]认为硫酸盐还原菌的参与是草莓状黄铁矿形成的必要条件;Sawlowicz[33-34]发现富有机制黑色页岩中往往赋存大量的草莓状黄铁矿;MacLean et al.[35]与Wacey et al. [36]分别指出草莓状黄铁矿的微晶生长在预先形成的有机质结构构成的空间内;以及Kershaw et al.[37]在现代黑海中观察到部分草莓状黄铁矿是悬浮于有机物中进行沉积的。在此基础上有学者提出了草莓状黄铁矿的有机成因说。但随着草莓状黄铁矿形成机制研究的进一步深入,尤其在一些缺乏有机物的极端环境下,如高温形成的火山岩中以及热液金属矿物中也存在草莓状黄铁矿的分布[2, 38],有机成因说受到越来越多的质疑。
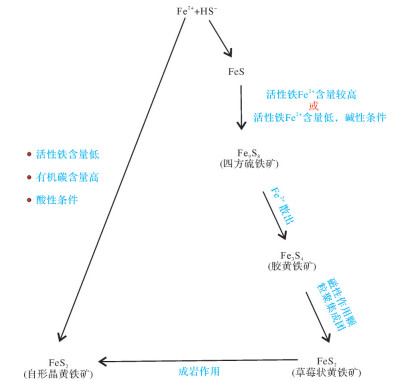
继Berner[31]提出草莓状黄铁矿的无机生成模式之后,大量报道称草莓状黄铁矿的微晶聚集结构的形成过程与生物作用无关。Garrels et al. [39]认为草莓状黄铁矿形成于早成岩期,并与大气中氧含量与海水中硫酸盐聚集相关。而后众多学者开展了草莓状黄铁矿人工合成实验[6, 40]以及对现代黑海中草莓状黄铁矿的形成过程及粒径分布研究[1, 41],进一步表明草莓状黄铁矿形成于沉积过程中的准同生期或成岩作用早期,其过程主要受控于水体的化学条件。Wilkin et al.[42]与Raiswell[43]认为草莓状黄铁矿的形成主要包含四个基本过程,其中胶黄铁矿是关键的中间产物(图 1):
(1) 水体中活性铁浓度较高的条件下,Fe2+与HS-首先形成无序的一硫化铁(FeS);
(2) 活性铁浓度较高,或活性铁浓度低但pH值高(碱性)的条件下,一硫化铁(FeS)转变为四方硫铁矿(Fe9S8);
(3) 四方硫铁矿(Fe9S8)中的Fe2+散出,形成胶黄铁矿(Fe3S4);
(4) 胶黄铁矿(Fe3S4)微晶在磁性作用下聚合成不稳定态的草莓状胶黄铁矿,继而转变为稳定态的草莓状黄铁矿。
而在水体中活性铁含量低,有机质含量较高且pH值低(酸性)的情况下,溶液对于一硫化铁(FeS)不饱和,而对于黄铁矿(FeS2)饱和,所以此时的溶液中可直接结晶生成晶核,经晶体生长形成自形晶黄铁矿(FeS2)。受到成岩作用影响时,自形晶黄铁矿(FeS2)还可由草莓状黄铁矿(FeS2)过大生长而形成[44]。
基于该反应过程,得出草莓状黄铁矿形成需要满足以下条件:首先有充足的Fe2+、H2S以及部分氧化态硫,其次是利用氧化物提供的硫元素,或部分氧化态的硫化合物将硫化铁(FeS)转化为胶黄铁矿(Fe3S4)。海水中的氧化还原界面可满足上述所有条件,且在现代黑海的观察中,草莓状黄铁矿亦被证实大量出现在氧化还原界面上下[45]。由此可知,草莓状黄铁矿形成的场所正是氧化还原界面附近[1, 43],此发现为草莓状黄铁矿粒径分布应用于古海洋氧化还原环境重建奠定了基础。
-
Wilkin et al.[1]对黑海、萨尼克湾等现代硫化环境与正常的现代海洋中发现的草莓状黄铁矿进行对比,发现在氧化水体和硫化水体中草莓状黄铁矿的形成机理差异很大,且其粒径大小、分布范围及微晶晶形皆取决于形成时的氧化还原条件。在水循环良好的氧化海中,底层水体含氧量正常,氧化还原界面往往在水岩界面之下。硫酸盐还原菌在氧化还原界面下的沉积物中不断地进行还原反应,导致局部环境的还原甚至硫化。此时,由于硫化氢和单质硫不间断地少量供给,草莓状黄铁矿的形成与生长需要较长的时间,从而更容易出现粒径较大的黄铁矿,且粒径均一性差。而在硫化的海洋环境下,氧化还原界面位于水体之中,草莓状黄铁矿的形成过程是在氧化还原界面附近的缺氧水体中完成的。由于此种环境下富含亚铁离子、硫化氢以及单质硫,且无沉积物依托,一旦草莓状黄铁形成便很快沉入海底,因此草莓状黄铁矿具有高的生长速率及较小的直径,且粒径分布范围极窄[1, 12, 22](图 2)。
在沉积岩中,草莓状黄铁矿粒径大小和形态很难受到后期改造的作用的影响,故此草莓状黄铁矿的粒径大小、分布规律对沉积时水体的氧化还原条件具有很好的指示意义[17, 21, 25-26]。随着前人对包括碳酸盐岩、黑色页岩、硅质岩等不同岩性开展草莓状黄铁矿粒径统计,最终恢复了前寒武纪、二叠纪以及三叠纪等多个重要地史时期的海洋氧化还原环境[13, 15, 17, 19-20, 24-26],该方法已成为重建古海洋氧化还原环境变化过程的有效手段[27, 45-46]。
-
在进行大量现代海洋中草莓状黄铁矿粒径统计研究的基础上,有学者建立了通过沉积岩中草莓状黄铁矿粒径分布规律反推古海洋氧化还原环境的模型[1, 12-14]。其中判别古环境主要使用的数据为草莓状黄铁矿的平均粒径(mean framboids diameter,简称MD)及最大粒径(maxmium framboids diameter,简称MFD)。Wilkin et al.[1]认为沉积于硫化海环境下的草莓状黄铁矿平均粒径为(5.0±1.7) μm,而沉积于氧化或次氧化环境下为(7.7±4.1) μm。一般情况下,硫化海中草莓状黄铁矿粒径大于10 μm的占比小于4%,而氧化或次氧化海中则占比10%~50%。除平均粒径外,草莓状黄铁矿的最大粒径也可作为古海洋的氧化还原条件的判别标准。通常硫化海中草莓状黄铁矿最大粒径数值一般小于20 μm,氧化—次氧化环境中最大粒径会大于20 μm;而氧化海中则往往会大于20 μm[1, 12-13]。Bond et al.[14]在草莓状黄铁矿粒径与氧化还原关系的研究中提出了更进一步的划分方案,当沉积物中出现大量平均粒径为3~5 μm的草莓状黄铁矿,且分布范围极窄,则其极可能是在硫化的水体中形成;当大量的粒径范围为4~6 μm,且仅有个别粒径大于10 μm,则其形成于缺氧的水体中;如果粒径范围为6~10 μm,且又有少数粒径大于10 μm,并出现了自形晶黄铁矿,那么它的沉积环境则是次氧化水体之下的沉积物中;由于硫的缺乏,次氧化环境的上层很难形成草莓状黄铁矿,此时的黄铁矿形成于成岩期,生长极为缓慢,极少有粒径 < 5 μm的分子出现,且其粒径范围很大;过渡到氧化环境中,黄铁矿大多以自形晶的形式出现,而硫酸盐还原带位于氧化还原界面之下,更加不利于草莓状黄铁矿的形成,此时有少量大粒径(> 10 μm)的草莓状黄铁矿形成于氧化还原界面稍靠下的位置,偶有草莓状黄铁矿形成于氧化还原界面之上的还原微环境中,且其粒径范围极大[44](表 1)。
表 1 草莓状黄铁矿特征与水体氧化还原环境的演化关系(据Wilkin et al. [1]; Bond et al.[14])
Table 1. Classification of water column redox conditions and corresponding features of pyrite framboids (after Wilkin et al.[1]; Bond et al. [14])
Wilkin et al.[1] Bond et al. [14] 水体环境 平均粒径 最大粒径 水体环境 平均粒径 最大粒径及其特征 沉积特征 氧化—次氧化环境 (Oxic-dysoxic) (7.7±4.1) μm 10 %~50 %颗粒粒径超过10 μm,MFD会大于20 μm 氧化环境 (oxic) 无草莓状黄铁矿,黄铁矿晶体亦少见 细水平纹层发育 上贫氧环境 upper dysoxic) 极少草莓状黄铁矿,且粒径范围极大,鲜有粒径 < 5 μm的分子出现 细水平纹层发育 下贫氧环境 (lower dysoxic) 6~10 μm 少数粒径较大,并有少量自形晶黄铁矿出现 细水平纹层发育,出现少量生物扰动 缺氧—硫化环境 (Anoxic-euxinic) (5.0±1.7) μm 大于10 μm的占比通常小于4%,MFD一般小于20 μm 缺氧环境 (anoxic) 4~6 μm 数量较多,少数个体较大(> 10 μm),且以草莓状黄铁矿为主 可见小潜穴,纹层被生物扰动破坏 硫化环境 (euxinic) 3~5 μm 数量丰富,粒径分布很窄,且以草莓状黄铁矿为主 潜穴发育,或块状构造 -
草莓状黄铁矿(Pyrite framboids)的定义为由相似大小、相似微晶形态的亚微米级黄铁矿颗粒组成的球形、亚球形聚合体。最初其命名源于法语中的覆盆子“framboise”,体现了莓状形态为其主要特征。微晶形态特征(相似大小、相似微晶形态)与外形特征(球形、亚球形)是草莓状黄铁矿与其他类型黄铁矿的重要区别,只有同时满足上述条件才能被称为“草莓状”黄铁矿。前人在草莓状黄铁矿合成实验与现代黑海的草莓状黄铁矿形成过程及粒径分布研究中发现草莓状黄铁矿微晶形态与外形特征与古海洋化学条件关系密切,一定程度上反映了古海洋氧化还原条件[5, 47]。
-
除草莓状黄铁矿的粒径大小与分布特征外,其微晶大小及形态也可作为反映沉积环境的重要条件[20]。一般来说,草莓状黄铁矿是由大小相近的微晶颗粒构成的聚合体,但当同一个草莓状黄铁矿中微晶大小存在差异,则可能说明微晶形成于不同时期,排除其在硫化环境水体中形成[26];而当草莓状黄铁矿具有较大的微晶,说明其生长的十分缓慢,极可能是成岩过程中形成的。
此外,草莓状黄铁矿的微晶形态通常有四面体、立方体、八面体(正八面体与截角八面体)、五角十二面体及球体(亚球体)。在草莓状黄铁矿合成实验中,随着化学实验条件的改变,得到的草莓状黄铁矿的晶体形态亦产生变化,主要有立方体[6, 47-49],正方体[6],八面体[6, 50-51]以及球形[6, 40, 42, 52-53](图 3)。Wang et al.[48]认为其微晶形态主要与反应溶液的过饱和度直接相关,随着过饱和度的增加,草莓状黄铁矿微晶形态的变化趋势为:立方体→八面体→球体。并且草莓状黄铁矿微晶形态与沉积环境中S/Fe的比值密切相关,随着微晶晶粒边数的增加,其S/Fe比值亦增加[54]。但不能排除研究中所观察到的部分球形微晶受到后期改造作用的影响。由此可知,在水体饱和度不高的非硫化缺氧条件下,易形成立方体微晶的草莓状黄铁矿,随着硫化程度的加深以及水体的过饱度的增加,形成的草莓状黄铁矿逐渐以球粒状微晶为主。
-
在草莓状黄铁矿人工合成实验过程中,当Fe、H2S、氧含量、反应温度等化学条件发生变化时,则形成黄铁矿(pyrites)、四方硫铁矿(mackinawite)、白铁矿(marcasite)、硫复铁矿(greigite)等不同的产物,且得到的黄铁矿形态结构也会发生变化,如草莓状黄铁矿(framboids)、假草莓状黄铁矿(pseudo-framboids)、充填型草莓状黄铁矿(infilled framboids)、自形晶黄铁矿(euhedral pyrites)等[5]。
自形晶黄铁矿是一种较为普遍的存在形式,一般可由黄铁矿直接析出,也可通过铁的单硫化物转化而来[5, 13]。与草莓状黄铁矿不同,其形成过程不产生胶黄铁矿,因此无法形成集合体形态。在封闭的成岩环境中,孔隙水中的铁离子与硫化氢随着消耗其浓度不断降低,更易于自形晶黄铁矿的析出[43],所以大量赋存的自形晶黄铁矿往往指示了氧化的古海洋环境。有学者在研究中观察到自形晶黄铁矿常与相似大小的草莓状黄铁矿颗粒相伴沉积,且发现有黄铁矿颗粒特征与草莓状黄铁矿相似,据此认为草莓状黄铁矿是作为黄铁矿的亚稳相存在的,在特定条件下,草莓状黄铁矿可以再次生长最终成为自形晶黄铁矿[2-26, 33]。而填充型草莓状黄铁矿(infilled ramboids),紧密型草莓状黄铁矿(massive framboids),过大生长草莓状黄铁矿(overgrown framboids)与环边草莓状黄铁矿(annular framboids)是草莓状黄铁矿向自形晶黄铁矿颗粒(图 4)生长的中间过渡状态[25-26, 33]。填充型草莓状黄铁矿的粒径比正常的草莓状黄铁矿颗粒略大,但此差异相较于整个粒径而言是极其微小的,对粒径统计分析结果不会产生影响[56],因此可以将填充型草莓状黄铁矿的粒径纳入统计范畴[26]。此外,Wacey et al. [36]在对草莓状黄铁矿的面扫分析中发现,许多草莓状黄铁矿发生二次生长,其粒径增大的程度明显干扰了粒径统计结果。Bailey et al. [55], Huang et al.[27]都观察到草莓状黄铁矿的次生加大边在SEM下是清晰可辨的。因此测量中一旦发现草莓状黄铁矿颗粒具有重结晶的放射状外环结构,则测量中心圈层的直径即可(图 4g)。

图 4 扫面电镜下不同形态的草莓状黄铁矿
Figure 4. Scanning electron microscope photographs of different pyrite morphologies
除上述类型外,赋存于沉积岩中的草莓状黄铁矿会随着外部环境的变化会发生氧化反应。其晶体表面氧化后呈砂糖状或绒毛状,笔者团队经过一系列实验验证发现其仍旧能够反映沉积时的古海洋环境,详见3.1。
-
扫描电镜待测试样品的制作一般分为光片样品与新鲜破碎面样品,两种方法各有优缺点:光片样品在扫描电子显微镜下所看到的草莓状黄铁矿为其截面(图 5b),很难恰好切到颗粒正中,所以相较于新鲜片状样品,光片测量出来的直径比真实粒径略小。但光面样品中的草莓状黄铁矿可进行面扫成分分析,并且可避免误测二次生长的草莓状黄铁矿;而新鲜片状样品在镜下所看到的草莓状黄铁矿则较为立体(图 5c,d),测量粒径的误差较小,实验的成本和时间上更有优势。
样品大小可根据扫描电镜型号进行调整,观察面一般为1~2 cm2。具体操作为:使用绝缘胶布将光片或经地质锤敲击后选取的平滑碎片年粘贴在样品底座上,样品表面须与底座平行,先用3%的稀硝酸清洗观察面,再用蒸馏水反复冲洗,烘干后喷镀金,即可上机进行扫描电镜观察及能谱仪成分测试。
-
样品一般以约4 000倍在背散射成像(BSED)下进行扫视,由于背散射成像下对于原子序数较高的元素反应出来的图像较亮,原子序数较低的元素图像则较暗,所以黄铁矿在背散射成像下一般较为明显(图 5b),如需立体结构的观察或拍摄可使用二次电子成像(ETD)进行(图 5c,d)。如前所述,草莓状黄铁矿的定义为由相似大小、相似微晶形态的亚微米级黄铁矿颗粒组成的球形、亚球形聚合体,镜下所测量的草莓状黄铁矿均须符合此定义。例如,扫描电镜下偶见松散的黄铁矿微晶分布,微晶大小、形态相似且有定向性,但由于外形并非球形、亚球形,所以仍不能将其认定为草莓状黄铁矿(图 4e)。
在测量地质样品中的草莓状黄铁矿粒径时,由于制备光片时很难正好切到球体中心,所以测量的粒径略小于其真实粒径。但当统计的个数超过100枚时,平均粒径的偏差≤10%[1]。且在SEM下,直径很小的草莓状黄铁矿存在被忽略的可能,这两种偏差在一定程度上可相互抵消。因此直接测量法得到的数据是相对精确的。并且由于扫描电镜下草莓状黄铁矿颗粒截面往往是椭圆形而非完美的圆形,所以单独选取某个直径进行测量则存在着随机的误差。因此,测量草莓状黄铁矿粒径可使用十字测量法,即分别测量椭球形的最短及最长直径,取其平均值作为最终测量值。
-
由于海洋的氧化还原环境可细分为:氧化环境、上贫氧环境、下贫氧环境、缺氧环境及硫化环境,仅仅依靠草莓状黄铁矿的平均粒径及最大粒径还不能足够细致的对氧化还原环境进行划分。为了使得草莓状黄铁矿粒径统计数据在重建古海洋氧化还原条件的研究中更加精确,草莓状黄铁矿的粒径数据需要进一步的分析与评估。其中最常用的方法有盒须图(box-whisker plot)、粒径正态分布图(size-frequency distribution)、草莓状黄铁矿平均粒径对标准偏差的二元图解(mean-standard diameter)以及草莓状黄铁矿平均粒径对偏态系数的图解(mean-skewness)。
盒须图是一种可以充分显示数据分散情况的统计图形,图中包含数据位置和分散情况的关键信息。草莓状黄铁矿粒径分布盒须图主要包含六个数据节点,包括最小值,下四分位数Q1,中位数,上四分位数Q3,最大值及异常值,将这一系列数据从小到大排列呈现(图 6a)。Wilkin et al.[1]最早将其运用在草莓状黄铁矿粒径分析上,这一应用更加直观的展现了草莓状黄铁矿在地层中粒径的变化情况及相关数据的分散特征。而后Chen et al.[23],Huang et al.[27]又将平均值加入数据节点,更加全面的显示粒径的数据分布情况。如今在草莓状黄铁矿粒径分析中,利用盒须图表示其在地层中的数据分散情况已十分普遍[1, 14, 21, 25-26, 58],一般可使用Excel 2016、Power BI、SPSS等软件进行盒须图的制作。
正态分布图亦称为常态分布图,它在统计学上代表非常重要的概率分布。正态曲线一般呈左右对称的钟形,两头低,中间高(图 6b)。在草莓状黄铁矿粒径统计过程中,相应的统计量在大样本时应近似正态分布。一旦数据不满足正态分布规律,则可能意味着统计样本的数据并不足够可信,遂正态分布图作为统计数据可信度的检验手段常与盒形图联用[1, 11, 13, 23, 27-28]。
Wilkin et al.[1]将现代海洋中关于草莓状黄铁矿的粒径数据进行投点,制成草莓状黄铁矿平均粒径对标准偏差的二元图解以及草莓状黄铁矿平均粒径对偏态系数的图解。根据前人研究中的草莓状黄铁矿粒径数据及相应的氧化—还原环境,在平均粒径对标准偏差的二元图解上划分出了硫化环境与贫氧—氧化环境(图 7a)。此后将研究中获得的草莓状黄铁矿粒径数据在此图上进行投点,根据点位即可区分出硫化环境或贫氧—氧化环境。
该方法已成为草莓状黄铁矿粒径统计分析的重要手段[22, 25-26, 59]。Wei et al.[26]在随后的研究中将草莓状黄铁矿平均粒径对标准偏差的二元图解进一步细分,区分出了硫化环境、缺氧环境、贫氧—氧化环境。而草莓状黄铁矿平均粒径对偏态系数的图解能够指示粒径分布的不均性(图 7b),粒径2~7 μm范围内,偏态系数越小,环境越还原,反之则越氧化。
-
近年来,有学者认为利用草莓状黄铁矿恢复古海洋氧化还原条件的方法存在一定的问题[11, 60]。这些问题值得进一步深入探讨,从而不断完善实验与分析环节,提高草莓状黄铁矿统计方法的可靠性。
(1) 不能指示底层海水的氧化还原条件
Algeo et al.[61]在对早三叠世的日本泛大洋进行研究时,发现Ubara剖面中的两种指标所指示的氧化还原环境存在矛盾:氧化还原敏感元素所指示的海底为贫氧—氧化条件,丰富的小粒径草莓状黄铁矿又指示了该时期应为缺氧—硫化环境。Algeo et al.[61]指出这一矛盾的原因是因为楔形硫化的氧化还原结构的存在,海洋中发育氧含量最小带(OMZ),此时草莓状黄铁矿的形成场所不再是氧化还原界面上下,而是OMZ附近,随后掉落到底部的沉积物中。其中,微量元素指示的贫氧—氧化条件为泛大洋底部的环境,而草莓状黄铁矿指示的硫化状态反应的是水体中OMZ的氧化还原条件。但这种条件十分特殊,只有当古海洋发育OMZ,且剖面位置完全位于OMZ之下时,草莓状黄铁矿才无法准确指示底层水的氧化还原状态。
(2) 可能仅反映微环境的氧化还原条件
之后不久,Vietti et al.[62]设计的模拟实验,得出草莓状黄铁矿粒径并不可靠,只能反应骨骼表面微环境的氧化还原状态的结论。他在水箱中模拟了氧化的海洋环境,并放入海洋动物的骨骼。三周后他发现在海洋动物的骨骼表面生长出了大量平均粒径约3 μm且粒径分布范围很窄的草莓状黄铁矿,符合硫化海的标准。他认为细菌在对骨骼的分解过程中需要消耗大量的氧气,从而在骨骼表面形成了局部的缺氧环境,进而形成了草莓状黄铁矿。但是,实际上早期成岩作用一般会持续数年到数千年,该实验的整个过程只有3周,草莓状黄铁矿会随着实验时间的增加而持续增长。所以该实验结果无法与自然沉积的结果作对比。
(3) 质疑草莓状黄铁矿非原地埋藏
Kershaw et al.[37, 63]在中国南方P-T界线附近的浅水微生物岩中发现了附着在笔石及角石介壳上的草莓状黄铁矿颗粒。根据草莓状黄铁矿的形成机制,其大量的出现代表了沉积时古海洋为缺氧环境,这与大量宏观生物出现所代表的氧化海环境相矛盾。所以他认为在浅水微生物岩内发现的草莓状黄铁矿并不一定是原地埋藏的,可能是再沉积带入的。其可能的形成模式有两种:1)部分草莓状黄铁矿形成后在沉降过程中附着在有机质之上,这部分草莓状黄铁矿的沉降速率也许远低于正常沉降的部分,从而与后期的介壳化石一同沉积;2)根据海洋环流模式研究[64],在现代黑海之中偶有发生的上升流导致了海洋氧化还原界面附近的水流不稳定,草莓状黄铁矿会随着上升流穿过氧化还原界面沉积到浅海的氧化水体中[37]。但是再沉积现象并不普遍,且一般都会具有特殊沉积结构或构造[11]。
因此,在利用草莓状黄铁矿粒径分析方法时亦需要结合沉积特征,化石分布情况,地球化学指标等多方面证据对环境进行综合判别,甄别特殊条件下沉积的草莓状黄铁矿。
-
尽管众多学者认为,相较于其他指示古海洋氧化还原状态的指标,草莓状黄铁矿粒径分析法能够更好的抵御后期改造的影响[27, 65-66],但还是有学者质疑后期氧化作用对草莓状黄铁矿粒径的影响。沉积地层在较大的变质或风化作用下,易导致岩石中的各种化学元素发生迁移,此类样品中的地球化学数据无法准确反映沉积时的氧化还原环境。然而即使草莓状黄铁矿的化学成分发生变化,其仍能保持原始的粒径大小和总体形态[1]。笔者团队在对中国塔西北地区大湾沟剖面、印度克什米尔地区Guryul Ravine剖面和Barus Spur的草莓状黄铁矿进行观察时,发现了很多“草莓状黄铁矿”表面呈绒毛状(图 8),且主要成分为Fe和O(图 9)。那么就需要探明这些铁的氧化物是由草莓状黄铁矿氧化形成的,还是仅仅是铁的氧化物形成的球状聚合体。如果原始成分是铁的氧化物,则必须将其剔除,不能用于氧化还原环境的分析[11]。
-
对740枚“草莓状球形聚合体”外表面进行了能谱分析,其中305枚成分为Fe和S,另有435枚不含S,主要成分为Fe和O[11, 28]。经分析,样品中的“草莓状球形聚合体”可确定是由草莓状黄铁矿经过氧化作用形成的,理由如下。
(1) 微晶晶形与草莓状黄铁矿一致。大多数“草莓状铁的氧化物”微晶为立方体、五角十二面体和八面体,与典型的黄铁矿晶型一致。而如果是铁的氧化物则晶型应截然不同:针铁矿为针状,赤铁矿为六角片状或菱面体[67];尽管磁铁矿常为八面体,一些铁的氧化物也会偶现立方体晶型,但均不会聚合为草莓状。只有草莓状黄铁矿微晶可同时呈现立方体、五角十二面体和八面体,且聚合为球形、亚球形集合体。因此从形态学上,这些“草莓状铁的氧化物”是草莓状黄铁矿在后期氧化作用下所形成的[11]。
(2) 分布集中于个别样品而非随机。研究过程中发现,这些“草莓状铁的氧化物”总是集中分布于某些层位(图 10)。剖面上不同层位的样品所受后期氧化作用的程度差异较大,但每个样品相对于沉积地层而言十分微小,可将样品内部受氧化作用的影响视作是相同的。
统计后发现,“草莓状铁的氧化物”的出现与样品受到氧化作用的程度呈正相关性。几乎所有出现“草莓状铁的氧化物”的样品比其他样品受到更明显的氧化作用影响[11]。这正是“草莓状铁的氧化物”由草莓状黄铁矿氧化而来的又一有力证据。
(3) 粒径分布特征相似。研究中对草莓状黄铁矿和“草莓状铁的氧化物”的粒径分别进行了统计分析,二者的平均值、中位值、最小值及最大值之间的差异≤3.42%,盒须图与直方图亦无明显差异(图 11、表 2)。由于两组对比数据数量不同(305 vs 435),不能进行相关性分析。因此,笔者从“草莓状球形聚合体组”中分10次随机抽取305枚,将“草莓状黄铁矿组”粒径数据与随机抽取获得的10组数据依次进行回归分析。得到的决定系数为0.975~0.988,斜率为0.885~1.099,截距为-0.587~+0.533,证明二者的粒径分布特征极其相似[11]。

图 11 草莓状黄铁矿和草莓状铁的氧化物粒径分布的盒须图以及直方图
Figure 11. Box-and-whisker plot (outliers are not shown) and histogram show that both pyrite framboids and iron oxide framboids share similar size distribution patterns (after Huang[11])
表 2 草莓状黄铁矿和草莓状铁的氧化物粒径数据(据黄元耕[11])
Table 2. Different size data for pyrite framboids and oxidized pyrite framboids (after Huang[11])
类别 平均值(mean) 标准差(SD) 中位值(midian) 最小值(min) 最大值(MFD) 数量(n) 草莓状黄铁矿 4.66 μm 4.66 μm 7.84 μm 6.61 μm 33.01 μm 305 草莓状铁的氧化物 6.49 μm 4.28 μm 7.67 μm 1.84 μm 31.88 μm 435 差值 1.82 % — 2.17 % 2.65 % 3.42 % — (4) 内部成分与草莓状黄铁矿一致。由于EDS的分析结果只反映颗粒表面的成分,无法获取颗粒内部的成分信息。因此笔者团队又将部分样品表面进行剖光,在扫描电镜下对“草莓状铁的氧化物”横截面进行EDS成分面扫分析。结果证实,“草莓状铁的氧化物”基本只有外表面在氧化作用下发生了成分变化,其内部主要成分依然是Fe和S[11](图 12)。因此,可认定草莓状铁的氧化物只是外层被氧化的草莓状黄铁矿,其粒径是可以纳入统计范畴对氧化还原环境进行判别的。
综上所述,样品中出现大量氧化的草莓状黄铁矿可能是由风化作用和地下水的侵入导致的,而在这些作用下,也极可能导致某些化学元素的迁移,最终致使原始地球化学信息的改变,所以在此类样品中进行地球化学分析时须十分小心[11]。
-
黄铁矿氧化的产物通常为铁的氧化物或是铁的硫化物,黄铁矿的氧化反应一般包含以下三种情况[68-69]:
(1) (2) (3) 在理想状态下,黄铁矿被氧化为铁的硫化物如方程(4)、(5)所示:
(4) (5) 以上反应会导致矿物体积增大约350%[70],内部形成及同心状纹层,外部则呈足球状,显著改变草莓状黄铁矿的外形[71]。在草莓状黄铁矿粒径统计时可较易排除此种矿物颗粒。所有样品在进行能谱成分分析时没有发现Fe、S和O元素同时出现,因此研究中的黄铁矿的氧化产物不包括铁的硫化物[11]。
针铁矿(FeOOH),磁铁矿(Fe3O4)和赤铁矿(Fe2O3)是常见的铁的氧化物。而在黄铁矿向这些矿物转化的反应中,会减小原始矿物13.03%到38.06%的体积:
(6) Volume = 158.96 Å3 Volume = 138.25 Å3
(7) Volume = 119.22 Å3 Volume = 73.85 Å3
(8) Volume = 79.48 Å3 Volume = 50.2 Å3
由于完全氧化的黄铁矿颗粒无法保留原始的草莓状集合体形态[42],所以在粒径统计中看到的草莓状黄铁矿至多只经历了表层的氧化。前文所述,表面发生氧化的草莓状黄铁矿的平均粒径与新鲜的草莓状黄铁矿相差2.17%,中位数粒径相差1.82%。由于粒径统计中可允许的系统误差为 < 10%[1],而氧化作用对草莓状黄铁矿的粒径影响远小于此,因此不会对古海洋氧化还原环境的解释产生影响[11]。
-
前人在对现代黑海的草莓状黄铁矿形成过程、粒径分布研究及草莓状黄铁矿人工合成实验中,系统的总结了草莓状黄铁矿的形成机制及其与水体氧化还原条件的相关性,为草莓状黄铁矿粒径统计分析方法在恢复古海洋环境方面的应用奠定了坚实的基础。随着该方法的广泛应用,学者们也提出了一些可能存在的问题,包括:某些情况下草莓状黄铁矿不能指示底层海水的氧化还原条件,仅反映微环境的氧化还原条件,质疑其非原地埋藏以及后期风化作用对粒径大小存在较大影响等。笔者团队研究发现,风化样品由于地下水的侵入和风化作用,出现了大量由草莓状黄铁矿转变而来的铁的氧化物,但氧化作用仅限于草莓状黄铁矿的表面。虽然表面氧化的草莓状黄铁矿的平均粒径比原始粒径减小2.17%,中位数粒径减小1.82%,但仍在粒径统计的系统误差范围内,因此不会对古海洋氧化还原环境的解释产生影响。只要在分析过程中结合沉积特征,化石分布情况,地球化学指标等多方面证据对环境进行综合判别,甄别特殊条件下沉积的草莓状黄铁矿,则可有效避免这些问题,提高草莓状黄铁矿粒径统计分析方法的可靠性与准确性。
The Microscopic Analysis of Pyrite Framboids and Application in Paleo-oceanography
-
摘要: 草莓状黄铁矿是黄铁矿的特殊形态,其定义为由相近大小、相似形态的黄铁矿微晶颗粒组成的球形、亚球形聚合体。草莓状黄铁矿粒径分析已广泛应用于各个地质历史时期的古海洋环境恢复研究中,但其形成机理、判别标准与实验方法仍存在分歧。因此对沉积地层中草莓状黄铁矿的形成机理、在古海洋环境恢复中的指示意义及判别标准、实验与数据分析方法等进行总结阐述,有助于理解草莓状黄铁矿的粒径大小与形态对氧化还原条件的指示意义。草莓状黄铁矿在不同氧化还原环境下的形成机理存在差异,其粒径大小、数量以及分布范围可综合反映沉积时水体的氧化还原条件;而草莓状黄铁矿微晶几何形态及整体形貌特征也与古海洋氧化还原环境密切相关。此外,虽然有学者指出该方法可能存在一些问题,但只要在分析过程中结合沉积特征、古生态特征、地球化学指标等多方面证据对环境进行综合判别,甄别特殊条件下沉积的草莓状黄铁矿,则可有效避免这些问题。最后,针对后期氧化作用对草莓状黄铁矿粒径分布的影响进行了评价,结果显示经过后期氧化作用的草莓状黄铁矿粒径变化很小,不会对其在恢复古海洋氧化还原环境的应用上产生影响。Abstract: Pyrite framboids are defined as microscopic spheroidal to sub-spheroidal clusters of equidimensional and equimorphic pyrite microcrystals. The size distribution of pyrite framboids has been widely used as a promising tool for reconstructing the redox conditions of geological periods. Summarizing the formation mechanism, paleo-oceanographic implications, discrimination standard, and experimental methods using pyrite framboids might help to understand why they play such an important role. The formation mechanism of pyrite framboids differs in oxic and euxinic conditions. Their size, abundance and distribution range are all important proxies in inferring the oxygen levels of the water column. The microcrystal geometries and morphological characteristics are closely related to the redox condition of the paleo-ocean in the deposition process. Furthermore, although one or two unknown problems may yet be present in the method, their potential effect may be offset by using additional effective methods (e.g., sedimentary microfacies analysis, paleocommunity reconstruction, and specific geochemical indices) to analyze the redox condition and to recognize unusual settings. The validity of the oxidized pyrite framboid in reconstructing the redox conditions of paleo-ocean has been evaluated. The results show that the oxidation of pyrite has little effect on redox interpretations based on pyrite framboid distributions.
-
Key words:
- pyrite framboids /
- formation mechanism /
- paleo-ocean /
- redox condition /
- oxidation of pyrite
-
图 4 扫面电镜下不同形态的草莓状黄铁矿
(a)正常的草莓状黄铁矿;(b)正常的草莓状黄铁矿部分微晶间隙被填充;(c)填充型草莓状黄铁矿,可见后期填充过程中晶粒包裹式生长;(d)过大生长草莓状黄铁矿与自形晶黄铁矿伴生,其中过大生长草莓状黄铁矿晶粒大小不一,外围晶粒较大且杂乱;(e)同一个样品中出现的黄铁矿晶粒大小差异很大;(f)自形晶黄铁矿(Chang et al.[15]);(g)(h)再结晶的草莓状黄铁矿横截面呈花朵状,即内部的原生草莓状黄铁矿被重结晶的放射状晶粒包裹(Bailey et al.[55];Wacey et al.[36])
Figure 4. Scanning electron microscope photographs of different pyrite morphologies
图 11 草莓状黄铁矿和草莓状铁的氧化物粒径分布的盒须图以及直方图
Figure 11. Box-and-whisker plot (outliers are not shown) and histogram show that both pyrite framboids and iron oxide framboids share similar size distribution patterns (after Huang[11])
表 1 草莓状黄铁矿特征与水体氧化还原环境的演化关系(据Wilkin et al. [1]; Bond et al.[14])
Table 1. Classification of water column redox conditions and corresponding features of pyrite framboids (after Wilkin et al.[1]; Bond et al. [14])
Wilkin et al.[1] Bond et al. [14] 水体环境 平均粒径 最大粒径 水体环境 平均粒径 最大粒径及其特征 沉积特征 氧化—次氧化环境 (Oxic-dysoxic) (7.7±4.1) μm 10 %~50 %颗粒粒径超过10 μm,MFD会大于20 μm 氧化环境 (oxic) 无草莓状黄铁矿,黄铁矿晶体亦少见 细水平纹层发育 上贫氧环境 upper dysoxic) 极少草莓状黄铁矿,且粒径范围极大,鲜有粒径 < 5 μm的分子出现 细水平纹层发育 下贫氧环境 (lower dysoxic) 6~10 μm 少数粒径较大,并有少量自形晶黄铁矿出现 细水平纹层发育,出现少量生物扰动 缺氧—硫化环境 (Anoxic-euxinic) (5.0±1.7) μm 大于10 μm的占比通常小于4%,MFD一般小于20 μm 缺氧环境 (anoxic) 4~6 μm 数量较多,少数个体较大(> 10 μm),且以草莓状黄铁矿为主 可见小潜穴,纹层被生物扰动破坏 硫化环境 (euxinic) 3~5 μm 数量丰富,粒径分布很窄,且以草莓状黄铁矿为主 潜穴发育,或块状构造 表 2 草莓状黄铁矿和草莓状铁的氧化物粒径数据(据黄元耕[11])
Table 2. Different size data for pyrite framboids and oxidized pyrite framboids (after Huang[11])
类别 平均值(mean) 标准差(SD) 中位值(midian) 最小值(min) 最大值(MFD) 数量(n) 草莓状黄铁矿 4.66 μm 4.66 μm 7.84 μm 6.61 μm 33.01 μm 305 草莓状铁的氧化物 6.49 μm 4.28 μm 7.67 μm 1.84 μm 31.88 μm 435 差值 1.82 % — 2.17 % 2.65 % 3.42 % — -
[1] Wilkin R T, Barnes H L, Brantley S L. The size distribution of framboidal pyrite in modern sediments:An indicator of redox conditions[J]. Geochimica et Cosmochimica Acta, 1996, 60(20):3897-3912. doi: 10.1016/0016-7037(96)00209-8 [2] Love L G, Amstutz G C. Review of microscopic pyrite from the Devonian chattanooga shale and rammelsberg banderz[J]. Fortschritte der Mineralogie, 1966, 43:273-309. [3] Hallbauer D K. The mineralogy and geochemistry of Witwatersrand pyrite, gold, uranium, and carbonaceous matter[M]//Anhaeusser C R, Maske S. Mineral deposits of southern Africa. Johannesburg: Geological Society of South Africa, 1986: 731-752. [4] Sassano G P, Schrijver K. Framboidal pyrite; Early-diagenetic, Late-diagenetic, and hydrothermal occurrences from the Acton Vale quarry, Cambro-Ordovician, Quebec[J]. American Journal of Science, 1989, 289(2):167-179. http://cn.bing.com/academic/profile?id=7f064715152472b5ea21ebc8b7907e38&encoded=0&v=paper_preview&mkt=zh-cn [5] Ohfuji H, Rickard D. Experimental syntheses of framboids-a review[J]. Earth-Science Reviews, 2005, 71(3/4):147-170. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=8f8a96aec6691de39e5b218bb0ee0a0d [6] Sweeney R E, Kaplan I R. Pyrite framboid formation; laboratory synthesis and marine sediments[J]. Economic Geology, 1973, 68(5):618-634. doi: 10.2113/gsecongeo.68.5.618 [7] Perry K A, Pedersen T F. Sulphur speciation and pyrite formation in meromictic ex-fjords[J]. Geochimica et Cosmochimica Acta, 1993, 57(18):4405-4418. doi: 10.1016/0016-7037(93)90491-E [8] Rust G W. Colloidal primary copper ores at Cornwall mines, southeastern Missouri[J]. The Journal of Geology, 1935, 43(4):398-426. doi: 10.1086/624318 [9] Rickard D T. The origin of framboids[J]. Lithos, 1970, 3(3):269-293. doi: 10.1016/0024-4937(70)90079-4 [10] Massaad M. Framboidal pyrite in concretions[J]. Mineralium Deposita, 1974, 9(1):87-89. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=b0ff385ee4c13602eef6d83fff6b5f0a [11] 黄元耕.华南及新疆地区二叠纪至三叠纪海洋、陆地古群落模拟及海洋氧化还原环境变化研究[D].武汉: 中国地质大学, 2018. Huang Yuangeng. Ecological modeling of marine and terrestrial paleocommunities in South China and Xinjiang during Permian and Triassic and marine redox variations[D]. Wuhan: China University of Geosciences, 2018. [12] Wilkin R T, Arthur M A. Variations in pyrite texture, sulfur isotope composition, and iron systematics in the Black Sea:Evidence for Late Pleistocene to Holocene excursions of the O2-H2S redox transition[J]. Geochimica et Cosmochimica Acta, 2001, 65(9):1399-1416. doi: 10.1016/S0016-7037(01)00552-X [13] Wignall P B, Newton R. Pyrite framboid diameter as a measure of oxygen deficiency in ancient mudrocks[J]. American Journal of Science, 1998, 298(7):537-552. doi: 10.2475/ajs.298.7.537 [14] Bond D P G, Wignall P B. Pyrite framboid study of marine Permian-Triassic boundary sections:A complex anoxic event and its relationship to contemporaneous mass extinction[J]. GSA Bulletin, 2010, 122(7/8):1265-1279. doi: 10.1130-B30042.1/ [15] Chang X L, Hou M C, Liu X C, et al. Abundant microspherules from the Upper Ordovician of northern Tarim Basin, Northwest China:Origin and palaeoenvironmental implications[J]. Geological Journal, 2018, 53(6):2896-2907. doi: 10.1002/gj.3128 [16] Passier H F, Middelburg J J, De Lange G J, et al. Pyrite contents, microtextures, and sulfur isotopes in relation to formation of the youngest eastern mediterranean sapropel[J]. Geology, 1997, 25(6):519-522. doi: 10.1130/0091-7613(1997)025<0519:PCMASI>2.3.CO;2 [17] Wignall P B, Newton R, Brookfield M E. Pyrite framboid evidence for oxygen-poor deposition during the Permian-Triassic crisis in Kashmir[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2005, 216(3/4):183-188. http://cn.bing.com/academic/profile?id=50c33ca9d1e5b2fadd79a890003612a3&encoded=0&v=paper_preview&mkt=zh-cn [18] Hofmann P, Ricken W, Schwark L, et al. Carbon-sulfur-iron relationships and δ13C of organic matter for Late Albian sedimentary rocks from the north Atlantic Ocean:Paleoceanographic implications[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2000, 163(3/4):97-113. https://www.sciencedirect.com/science/article/abs/pii/S0031018200001474 [19] Wei H Y, Chen D Z, Wang J G, et al. Organic accumulation in the Lower Chihsia Formation (Middle Permian) of South China:Constraints from pyrite morphology and multiple geochemical proxies[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2012, 353-355:73-86. doi: 10.1016/j.palaeo.2012.07.005 [20] 韦雪梅, 韦恒叶, 邱振, 等.广西来宾蓬莱滩剖面G-L界线草莓状黄铁微晶粒径特征及其氧化还原意义[J].地质科学, 2017, 52(1):230-241. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=dzkx201701016 Wei Xuemei, Wei Hengye, Qiu Zhen, et al. Framboidal microcryst size characteristics of pyrite and its redox significance across the G-L boundary in Penglaitan section, Laibin, Guangxi[J]. Chinese Journal of Geology, 2017, 52(1):230-241. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=dzkx201701016 [21] Wei H Y, Jiang X C. Early Cretaceous ferruginous and its control on the lacustrine organic matter accumulation:Constrained by multiple proxies from the Bayingebi Formation in the Bayingebi Basin, inner Mongolia, NW China[J]. Journal of Petroleum Science and Engineering, 2019, 178:162-179. doi: 10.1016/j.petrol.2019.03.037 [22] 常华进, 储雪蕾.草莓状黄铁矿与古海洋环境恢复[J].地球科学进展, 2011, 26(5):475-481. http://d.old.wanfangdata.com.cn/Periodical/dqkxjz201105002 Chang Huajin, Chu Xuelei. Pyrite framboids and palaeo-ocean redox condition reconstruction[J]. Advances in Earth Science, 2011, 26(5):475-481. http://d.old.wanfangdata.com.cn/Periodical/dqkxjz201105002 [23] Chen Z Q, Yang H, Luo M, et al. Complete biotic and sedimentary records of the Permian-Triassic transition from Meishan section, South China:Ecologically assessing mass extinction and its aftermath[J]. Earth-Science Reviews, 2015, 149:67-107. doi: 10.1016/j.earscirev.2014.10.005 [24] Takahashi S, Yamasaki S I, Ogawa K, et al. Redox conditions in the end-early Triassic Panthalassa[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2015, 432:15-28. doi: 10.1016/j.palaeo.2015.04.018 [25] Wei H Y, Algeo T J, Yu H, et al. Episodic euxinia in the Changhsingian (Late Permian) of South China:Evidence from framboidal pyrite and geochemical data[J]. Sedimentary Geology, 2015, 319:78-97. doi: 10.1016/j.sedgeo.2014.11.008 [26] Wei H Y, Wei X M, Qiu Z, et al. Redox conditions across the G-L boundary in South China:Evidence from pyrite morphology and sulfur isotopic compositions[J]. Chemical Geology, 2016, 440:1-14. doi: 10.1016/j.chemgeo.2016.07.009 [27] Huang Y G, Chen Z Q, Wignall P B, et al. Latest Permian to Middle Triassic redox condition variations in ramp settings, South China:Pyrite framboid evidence[J]. GSA Bulletin, 2017, 129(1/2):229-243. http://cn.bing.com/academic/profile?id=b52fcb065d1d90195fd0f4d411c2c3bc&encoded=0&v=paper_preview&mkt=zh-cn [28] Huang Y G, Chen Z Q, Algeo T J, et al. Two-stage marine anoxia and biotic response during the Permian-Triassic transition in Kashmir, northern India:Pyrite framboid evidence[J]. Global and Planetary Change, 2019, 172:124-139. doi: 10.1016/j.gloplacha.2018.10.002 [29] Love L G. Mircro-organisms and the presence of syngenetic pyrite[J]. Quarterly Journal of the Geological Society, 1957, 113(1/2/3/4):429-440. http://cn.bing.com/academic/profile?id=a1fd0eaf36c695aa57a917d885282375&encoded=0&v=paper_preview&mkt=zh-cn [30] Love L G. Biogenic primary sulfide of the Permian Kupferschiefer and Marl Slate[J]. Economic Geology, 1962, 57(3):350-366. doi: 10.2113/gsecongeo.57.3.350 [31] Berner R A. Migration of iron and sulfur within anaerobic sediments during early diagenesis[J]. American Journal of Science, 1969, 267(1):19-42. http://cn.bing.com/academic/profile?id=578d0c8820977ffbac3cd298ca098ad3&encoded=0&v=paper_preview&mkt=zh-cn [32] Berner R A. Sedimentary pyrite formation:An update[J]. Geochimica et Cosmochimica Acta, 1984, 48(4):605-615. doi: 10.1016/0016-7037(84)90089-9 [33] Sawlowicz Z. Pyrite framboids and their development:A new conceptual mechanism[J]. Geologische Rundschau, 1993, 82(1):148-156. doi: 10.1007/BF00563277 [34] Sawlowicz Z. Organic matter and its significance for the genesis of the copper-bearing shales (Kupferschiefer) from the fore-sudetic monocline (Poland)[M]//Parnell J, Kucha H, Landais P. Bitumens in ore deposits. Berlin Heidelberg: Springer, 1993: 431-446. [35] MacLean L C W, Tyliszczak T, Gilbert P U P A, et al. A highresolution chemical and structural study of framboidal pyrite formed within a low-temperature bacterial biofilm[J]. Geobiology, 2009, 6(5):471-480. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=bc7aa809ab861b98a877718056c00d7f [36] Wacey D, Kilburn M R, Saunders M, et al. Uncovering framboidal pyrite biogenicity using nano-scale CNorg mapping[J]. Geology, 2014, 43(1):27-30. http://d.old.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0234267355/ [37] Kershaw S, Liu M. Modern black sea oceanography applied to the end-Permian extinction event[J]. Journal of Palaeogeography, 2015, 4(1):52-62. doi: 10.3724/SP.J.1261.2015.00067 [38] England B M, Ostwald J. Framboid-derived structures in some Tasman fold belt base-metal sulphide deposits, New South Wales, Australia[J]. Ore Geology Reviews, 1993, 7(5):381-412. doi: 10.1016/0169-1368(93)90002-G [39] Garrels R M, Perry E A. Cycling of carbon, sulfur, and oxygen through geologic time[M]//Goldberg E D. The sea. New York: John Wiley, 1974: 303-336. [40] Berner R A. The synthesis of framboidal pyrite[J]. Economic Geology, 1969, 64(4):383-384. doi: 10.2113/gsecongeo.64.4.383 [41] Degens E T, Ross D A. Chronology of the Black Sea over the last 25, 000 years[J]. Chemical Geology, 1972, 10(1):1-16. doi: 10.1016/0009-2541(72)90073-3 [42] Wilkin R T, Barnes H L. Formation processes of framboidal pyrite[J]. Geochimica et Cosmochimica Acta, 1997, 61(2):323-339. doi: 10.1016/S0016-7037(96)00320-1 [43] Raiswell R. Pyrite texture, isotopic composition and the availability of iron[J]. American Journal of Science, 1982, 282(8):1244-1263. doi: 10.2475/ajs.282.8.1244 [44] 曹丰龙, 韦恒叶.湖北省恩施地区二叠系低丰度草莓状黄铁矿的两种成因[J].东华理工大学学报(自然科学版), 2015, 38(2):158-166. doi: 10.3969/j.issn.1674-3504.2015.02.004 Cao Fenglong, Wei Hengye. Two causes for the low abundance of framboidal pyrite in the Permian in Enshi area in Hubei province[J]. Journal of East China Institute of Technology (Natural Science Edition), 2015, 38(2):158-166. doi: 10.3969/j.issn.1674-3504.2015.02.004 [45] Muramoto J A, Honjo S, Fry B, et al. Sulfur, iron and organic carbon fluxes in the Black Sea:Sulfur isotopic evidence for origin of sulfur fluxes[J]. Deep Sea Research Part A. Oceanographic Research Papers, 1991, 38(Suppl.2):S1151-S1187. http://cn.bing.com/academic/profile?id=8f5e2d3d57b311cafd3dec2e751c3061&encoded=0&v=paper_preview&mkt=zh-cn [46] Wignall P B, Twitchett R J. Extent, duration, and nature of the Permian-Triassic superanoxic event[M]//Koeberl C, MacLeod K C. Catastrophic events and mass extinctions: Impacts and beyond. Colorado: Geological Society of America, 2002, 356: 395-413. [47] Butler I B, Rickard D. Framboidal pyrite formation via the oxidation of iron (Ⅱ) monosulfide by hydrogen sulphide[J]. Geochimica et Cosmochimica Acta, 2000, 64(15):2665-2672. doi: 10.1016/S0016-7037(00)00387-2 [48] Wang Q W, Morse J W. Pyrite formation under conditions approximating those in anoxic sediments I. Pathway and morphology[J]. Marine Chemistry, 1996, 52(2):99-121. doi: 10.1016/0304-4203(95)00082-8 [49] Morse J W, Wang Q W. Pyrite formation under conditions approximating those in anoxic sediments:Ⅱ. Influence of precursor iron minerals and organic matter[J]. Marine Chemistry, 1997, 57(3/4):187-193. https://www.sciencedirect.com/science/article/pii/S0304420397000509 [50] Sunagawa I, Endo Y, Nakai N. Hydrothermal synthesis of framboidal pyrite[J]. Journal of Society of Mining Geologists of Japan, Special Issue, 1971, 2:10-14. [51] Luther Ⅲ G W. Pyrite synthesis via polysulfide compounds[J]. Geochimica et Cosmochimica Acta, 1991, 55(10):2839-2849. doi: 10.1016/0016-7037(91)90449-F [52] Farrand M. Framboidal sulphides precipitated synthetically[J]. Mineralium Deposita, 1970, 5(3):237-247. [53] Graham U M, Ohmoto H. Experimental study of formation mechanisms of hydrothermal pyrite[J]. Geochimica et Cosmochimica Acta, 1994, 58(10):2187-2202. doi: 10.1016/0016-7037(94)90004-3 [54] 李洪星, 陆现彩, 边立曾, 等.有孔虫壳体内草莓状黄铁矿成因及其地质意义:以湖北雁门口地区栖霞组有孔虫化石为例[J].高校地质学报, 2009, 15(4):470-476. doi: 10.3969/j.issn.1006-7493.2009.04.005 Li Hongxing, Lu Xiancai, Bian Lizeng, et al. Formation of pyrite framboids in the chamber of foraminiferas and its geological significance:A case study of the foraminiferas fossils in the Qixia Formation in the Yanmenkou area, Hubei province[J]. Geological Journal of China Universities, 2009, 15(4):470-476. doi: 10.3969/j.issn.1006-7493.2009.04.005 [55] Bailey J V, Raub T D, Meckler A N, et al. Pseudofossils in relict methane seep carbonates resemble endemic microbial consortia[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2010, 285(1/2):131-142. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=dd34dc0dd252f1370a21978af3007816 [56] Wang L, Shi X Y, Jiang G Q. Pyrite morphology and redox fluctuations recorded in the Ediacaran Doushantuo Formation[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2012, 333-334:218-227. doi: 10.1016/j.palaeo.2012.03.033 [57] 常晓琳.晚奥陶世古海洋环境演化过程: 来自塔里木和中扬子地区的沉积学与地球化学证据[D].成都: 成都理工大学, 2018. Chang Xiaolin. Late Ordovician paleoceanographic changing process: Sedimentary and geochemcial evidences from the Upper Ordovician of the Tarim Basin and middle Yangtze regions, China[D]. Chengdu: Chengdu University of Technology, 2018. [58] Wignall P B, Bond D P G, Sun Y D, et al. Ultra-shallow-marine anoxia in an Early Triassic shallow-marine clastic ramp (Spitsbergen) and the suppression of benthic radiation[J]. Geological Magazine, 2016, 153(2):316-331. doi: 10.1017/S0016756815000588 [59] 常华进, 储雪蕾, 冯连君, 等.华南老堡组硅质岩中草莓状黄铁矿:埃迪卡拉纪末期深海缺氧的证据[J].岩石学报, 2009, 25(4):1001-1007. http://d.old.wanfangdata.com.cn/Periodical/ysxb98200904024 Chang Huajin, Chu Xuelei, Feng Lianjun, et al. Framboidal pyrites in cherts of the Laobao Formation, South China:Evidence for anoxic deep ocean in the terminal Ediacaran[J]. Acta Petrologica Sinica, 2009, 25(4):1001-1007. http://d.old.wanfangdata.com.cn/Periodical/ysxb98200904024 [60] Rickard D. Sedimentary pyrite framboid size-frequency distributions:A meta-analysis[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2019, 522:62-75. doi: 10.1016/j.palaeo.2019.03.010 [61] Algeo T J, Kuwahara K, Sano H, et al. Spatial variation in sediment fluxes, redox conditions, and productivity in the Permian-Triassic Panthalassic Ocean[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2011, 308(1/2):65-83. http://www.sciencedirect.com/science/article/pii/S0031018210003913 [62] Vietti L A, Bailey J V, Fox D L, et al. Rapid formation of framboidal sulfides on bone surfaces from a simulated marine carcass fall[J]. Palaios, 2015, 30(4):327-334. doi: 10.2110/palo.2014.027 [63] Kershaw S, Tang H, Li Y, et al. Oxygenation in carbonate microbialites and associated facies after the end-Permian mass extinction:Problems and potential solutions[J]. Journal of Palaeogeography, 2018, 7(1):32-47. doi: 10.1016/j.jop.2017.10.001 [64] Mihailov M E, Tomescu-Chivu M I, Dima V. Black Sea water dynamics on the Romanian littoral-Case study:The upwelling phenomena[J]. Romanian Reports in Physics, 2012, 64(1):232-245. http://cn.bing.com/academic/profile?id=7a354ae892692149fe22865a9d5001c6&encoded=0&v=paper_preview&mkt=zh-cn [65] Lüning S, Kolonic S, Loydell D K, et al. Reconstruction of the original organic richness in weathered Silurian shale outcrops (Murzuq and Kufra basins, southern Libya)[J]. GeoArabia, 2003, 8(2):299-308. [66] 周杰, 邱振, 王红岩, 等.草莓状黄铁矿形成机制及其研究意义[J].地质科学, 2017, 52(1):242-253. http://d.old.wanfangdata.com.cn/Periodical/dzkx201701017 Zhou Jie, Qiu Zhen, Wang Hongyan, et al. Formation mechanism of pyrite framboid and its research significance[J]. Chinese Journal of Geology, 2017, 52(1):242-253. http://d.old.wanfangdata.com.cn/Periodical/dzkx201701017 [67] Cornell R M, Schwertmann U. The iron oxides:Structure, properties, reactions, occurences and uses[M]. 2nd ed. New York:Wiley-VCH, 2003:663. [68] Wiersma C L, Rimstidt J D. Rates of reaction of pyrite and marcasite with ferric iron at pH 2[J]. Geochimica et Cosmochimica Acta, 1984, 48(1):85-92. doi: 10.1016/0016-7037(84)90351-X [69] Williamson M A, Rimstidt J D. The kinetics and electrochemical rate-determining step of aqueous pyrite oxidation[J]. Geochimica et Cosmochimica Acta, 1994, 58(24):5443-5454. doi: 10.1016/0016-7037(94)90241-0 [70] Fasiska E J, Wagenblast N, Dougherty M T. The oxidation mechanism of sulphide minerals:6F, 6R. BULL. ASSOC. ENGNG. GEOL. V11, N1, 1974, P75-82[J]. International Journal of Rock Mechanics and Mining Sciences & Geomechanics Abstracts, 1974, 11(11):A222. doi: 10.1016/0148-9062(74)90512-9 [71] Hawkins A B. Sulphate heave:A model to explain the rapid rise of ground-bearing floor slabs[J]. Bulletin of Engineering Geology and the Environment, 2012, 71(1):113-117. doi: 10.1007/s10064-011-0408-1 -




 下载:
下载: